CLO là gì? Ứng dụng trong đời sống CLO
Hóa chất Clo vô cùng gần gũi và quen thuộc đối với mỗi chúng ta. Từ những bài học về hóa khi đi học đến trong đời sống hằng ngày chúng ta đều dễ dàng bắt gặp hóa chất Clo. Vậy hãy cùng mình xem qua những đặc điểm và ứng dụng qua bài viết dưới đây ngay nhé.
Clo là gì?
 Clo là một nguyên tố hóa học có ký hiệu Cl và ở chu kỳ thứ ba của bảng tuần hoàn. Clo có electron cao nhất và mạnh thứ ba trong tất cả các nguyên tố. Clo tồn tại ở hai dạng là lỏng và khí.Thuộc phân loại halogen. Khối lượng là khoảng 35,453g
Clo là một nguyên tố hóa học có ký hiệu Cl và ở chu kỳ thứ ba của bảng tuần hoàn. Clo có electron cao nhất và mạnh thứ ba trong tất cả các nguyên tố. Clo tồn tại ở hai dạng là lỏng và khí.Thuộc phân loại halogen. Khối lượng là khoảng 35,453g
Tính chất của Clo
Tính chất vật lí
- Clo ở thể khí, màu vàng lục, mùi clo rất mạnh ở điều kiện thường. Đây là một chất cực độc.
- Khi ở dạng phân tử, clo có khối lượng là 71 nên Cl nặng hơn không khí rất nhiều.
- Khí clo hòa tan vừa trong nước tạo thành nước clo có màu vàng nhạt và dễ tan trong dung môi hữu cơ. Khí clo là chất khí phản ứng tức thời với hầu hết các loại nguyên tố ở thể khí.
- Ở 10 ° C một lít nước hòa tan 3,10 lít clo và ở 30 ° C chỉ có 1,77 lít.
Tính chất hóa học
- Clo là phi kim nên có tính oxi hóa cực mạnh. Trong các hợp chất, clo thường có trạng thái oxi hóa là 1, trong các hợp chất với F hoặc O, các trạng thái oxi hóa của clo thường là +1, +3, + 5 hoặc + 7, và trong một số trường hợp, clo là chất khử
- Khi clo phản ứng với kim loại để tạo thành muối và tên của muối đó là muối halogenua. Đặc biệt, clo có thể phản ứng với hầu hết các kim loại trừ Au và Pt.
2Fe +3Cl2 => 2FeCl3
- Tạo hợp chất khí khi cho Clo tác dụng với Hidro
H2 + Cl2 => 2HCl
- Tạo ra HCl và HCLO khi cho Cl tác dụng với nước sẽ, đây được gọi là phản ứng 2 chiều.
H2O + Cl2 => HCl + HClO
- Khi clo phản ứng với các hợp chất khử, tính chất của clo có điểm giống với tính chất hóa học của flo và tính chất hóa học của brom, vì chúng cũng là những halogen có hoạt tính cao.
2FeCl2 + 2 NaBr => 2 NaCl + Br2
- Tạo ra nước Javen khi cho Clo tác dụng với dung dịch NaOH
Cl2 + 2NaOH → NaCl + NaClO + H2O
Điều chế clo như thế nào
Trong phòng thí nghiệm
- Khí clo được tạo ra bằng cách cho axit clohiđric đặc phản ứng với chất oxi hóa mạnh như mangan đioxit rắn (MnO2) hoặc kali pemanganat rắn (KMnO4)…
- MnO2 cần đun nóng, có thể đun nóng hoặc không đun nóng KMnO4. Khí clo Kết quả là thường lẫn với các chất gây ô nhiễm như khí hydro clorua và hơi nước để loại bỏ tạp chất, người ta cho khí clo theo thứ tự đi qua các bình lọc có chứa dung dịch NaCl (để duy trì khí HCl) và axit sunfuric đặc để duy trì hơi.
- Cho HCl phản ứng với chất oxi hóa mạnh (thường gặp: MnO2, KMnO4, K2Cr2O7, KClO3).
MnO2 + 4HCl => MnCl2 + Cl2 + 2H2O
2KMnO4 + 16HCl => 2KCl + 2MnCl2 + 5Cl2 + 6H2O
Trong công nghiệp
- Trong công nghiệp, quá trình sản xuất clo cần một lượng lớn clo nên cần sử dụng các nguyên liệu rẻ tiền và thông dụng để sản xuất. Đặc biệt, clo được tạo ra bằng quá trình điện phân muối natri nóng chảy.
2NaCl → 2Na + Cl2
- Bên cạnh đó, còn dùng phương pháp điện phân dung dịch muối có màng ngăn.
2NaCl + 2H2O → H2 + 2NaOH + Cl2
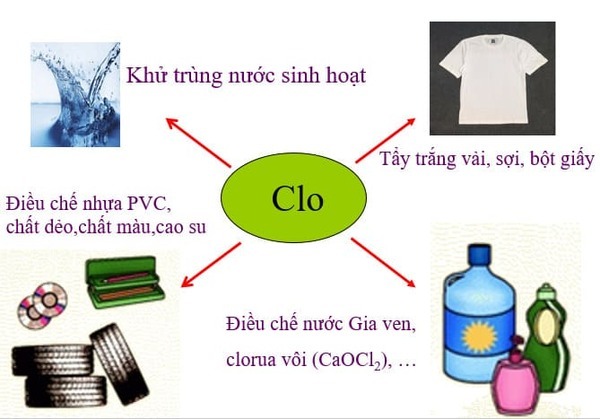
Ứng dụng của Clo trong thực tế
- Clo được biết đến chủ yếu trong sản xuất PVC, ngoài ra còn có trong nhựa và cao su.
- Clo có tác dụng khử trùng. Clo là khí được sử dụng phổ biến nhất. Khi được sử dụng trong xử lý nước, áp suất cao và làm chất tẩy rửa.
- Khí clo được sử dụng dưới dạng axit clohidric ClO để khử trùng bể bơi, hệ thống cấp nước và xử lý nước thải.
- Clo được sử dụng trong sản xuất giấy, thuốc nhuộm và thuốc, thuốc trừ sâu, sơn, v.v. và nhiều vật dụng hàng ngày khác.
Trên đây là những chia sẻ về hóa chất Clo đến các bạn. Mong rằng bạn sẽ hiểu hơn về các đặc điểm, tính chất và ứng dụng của chúng.
